¿Qué es el bicarbonato de amonio?
Saber qué es el bicarbonato amónico a partir de sus propiedades físicas y químicas
El bicarbonato de amonio es un compuesto blanco que aparece blanco a temperatura ambiente, cristales granulares, y tiene una traza de olor a amoníaco. Debe tenerse en cuenta en la conservación porque el bicarbonato amónico es un carbonato que reacciona con el ácido para formar dióxido de carbono. De este modo, el bicarbonato amónico se deteriora, por lo que no puede colocarse junto con el ácido.
En circunstancias normales, el almacenamiento del bicarbonato de amonio debe realizarse en un lugar fresco y seco. Durante el almacenamiento y el transporte, debe prestarse atención a la humedad, la lluvia y la exposición al sol. No debe mezclarse con oxidantes, ácidos o productos químicos.
El bicarbonato de amonio puede utilizarse como fertilizante para los cultivos
En el campo, se suelen utilizar las características del bicarbonato amónico y el ácido para reaccionar. En el espacio sellado, el bicarbonato de amonio se coloca en un lugar alto y se añade ácido clorhídrico diluido. Tras la reacción, se puede generar suficiente dióxido de carbono para la fotosíntesis de las plantas, aumentando así el rendimiento vegetal. El cloruro de amonio formado por la reacción también puede reutilizarse como fertilizante.
Por supuesto, el bicarbonato amónico también puede utilizarse como fertilizante nitrogenado. Puede proporcionar el nitrógeno amoniacal y el dióxido de carbono necesarios para el crecimiento de las plantas. Tras su aplicación al suelo, los iones de amonio y el dióxido de carbono contenidos en el bicarbonato amónico pueden ser absorbidos directamente por las plantas. Causará algunos residuos en el suelo y tiene poco efecto en la calidad del suelo.
Bicarbonato amónico como extintor de incendios
El bicarbonato de amonio también suele considerarse un material excelente para fabricar extintores. El bicarbonato de amonio y el sulfato de aluminio se pueden utilizar como material de extinción de incendios de dióxido de carbono, alúmina y sulfato de sodio. porque el carbonato en el bicarbonato de amonio es un anión ácido débil, aluminio. Es un catión base débil, y los dos iones promueven mutuamente la doble hidrólisis para formar una espuma que puede extinguir eficazmente el fuego.
El bicarbonato de amonio como agente leudante en los alimentos
El bicarbonato de amonio se utilizó por primera vez como agente leudante. Se fabricaba con los cuernos de los renos del suelo. También fue uno de los primeros polvos de hornear. Antes de la aparición del bicarbonato sódico y otros polvos de hornear, los europeos solían elaborar bicarbonato amónico. El bicarbonato amónico se descompone y libera amoníaco y dióxido de carbono. El gas esponjoso reacciona con el ácido esponjoso para que el alimento sea más esponjoso y elástico, ya que las galletas hechas con bicarbonato amónico no tienen ningún residuo de amonio, y también pueden garantizar al máximo el carácter crujiente de las galletas, por lo que algunos europeos han conservado esa costumbre.
Antes de la aparición de la levadura china moderna, se utilizaba a menudo para hacer galletas de almendra y bollos al vapor. Aunque había astringencia y olor a amoníaco durante el proceso de horneado, desaparecía rápidamente sin dejar sabor.
Otro nombre para el bicarbonato de amonio: starter
Además de agente leudante, el bicarbonato amónico tiene otro nombre, que es iniciador. De acuerdo con los ingredientes alimentarios especiales de la UE, hay 10 tipos de arranque, incluyendo E341 fosfato de calcio, E343 fosfato de magnesio, E450 DIFOSFATOS, E500 carbonato de sodio, E. 500 I carbonato de sodio, E 500 II - bicarbonato de sodio, E 500 III - sodio-sesquicarbonato, E 541 - fosfato de aluminio y sodio, ácido, E 574 - ácido glucónico, E 575 - Glucono-delta-lactona.
La mayoría de ellos actúan para ventilar la masa durante el proceso de horneado, aumentando la elasticidad y la viscosidad de la masa para conseguir el volumen óptimo del producto.
Método de síntesis del hidrogenocarbonato de amonio
Como se muestra en la figura siguiente, el dióxido de carbono comprimido se pasa a agua amoniacal concentrada para mantener el estado presurizado del dióxido de carbono, y la solución se enfría, se precipitan los cristales, se separan por centrifugación y se deshidratan para formar cristales de hidrogenocarbonato de amonio.
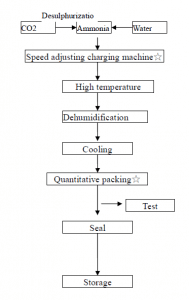
Algunas pequeñas plantas de fertilizantes nitrogenados típicas de China utilizan antracita como materia prima para preparar gas semiacuático. Este último entra en la torre de carbonización después de eliminar el sulfuro de hidrógeno, y la mezcla de nitrógeno, hidrógeno y dióxido de carbono obtenida en el sistema de reacción de conversión a presión entra en la torre de carbonización. Alrededor de 17% de agua amoniacal reacciona para formar cristales de bicarbonato de amonio, que se separan mediante una centrifugadora para obtener el producto de bicarbonato de amonio.
Precauciones de empleo del bicarbonato de amonio
Si accidentalmente toca la piel con una cierta concentración de bicarbonato de amonio, primero quite la ropa contaminada, enjuague con agua corriente, accidentalmente en contacto con los ojos para lavar con una cierta concentración de solución salina, si es necesario, debe buscar atención médica de inmediato, si Si accidentalmente inhala la boca, debe abandonar el lugar al aire fresco. Si tiene dificultad para respirar, debe buscar tratamiento médico inmediatamente después de oxígeno. Si accidentalmente comer, usted debe beber suficiente agua, y luego buscar atención médica inmediatamente después de vomitar.
Sinónimos: bicarbonato amónico; ácido carbónico, sal monoamónica; carbonato monoamónico; carbonato amónico ácido; hidrogenocarbonato amónico; cornamenta; AmBic;












